Enlaces covalentes
Los enlaces covalentes son un tipo de unión entre átomos que forma moléculas a través de la compartición de pares de electrones. Estos enlaces, los cuales representan un balance bastante estable entre cada especie, permiten a cada átomo alcanzar la estabilidad de su configuración electrónica.
El tipo de enlace covalente depende de la diferencia de electronegatividad entre especies, donde un valor entre 0 y 0,4 da como resultado un enlace no-polar, y una diferencia de 0,4 a 1,7 resulta en un enlace polar (los enlaces iónicos aparecen a partir de 1,7)

Tipos de enlaces covalentes
Enlace covalente apolar
El enlace covalente apolar se genera cuando los electrones son compartidos entre átomos de forma igualitaria. Esto generalmente ocurre cuando los dos átomos tienen una afinidad electrónica similar o igual (mismas especies). Mientras más parecidos sean los valores de afinidad electrónica entre los átomos involucrados, más fuerte será la atracción resultante.
Enlace covalente polar
El enlace covalente polar se da cuando existe una compartición desigual de electrones entre las dos especies involucradas en la unión. En este caso, uno de los dos átomos posee una electronegatividad considerablemente mayor que el otro, y por esta razón atraerá más a los electrones de la unión.
La molécula resultante tendrá un lado ligeramente positivo (aquel que tiene la menor electronegatividad), y otro lado ligeramente negativo (con aquel átomo con la mayor electronegatividad). También tendrá un potencial electrostático, proporcionándole al compuesto la capacidad de unirse débilmente a otros compuestos polares.
Enlace covalente simple
Es la compartición de un solo par de electrones; es decir, cada átomo involucrado comparte un solo electrón. Se representa con una raya entre los átomos; por ejemplo, en el caso de la molécula del hidrógeno (H2):
H-H
Enlace covalente doble
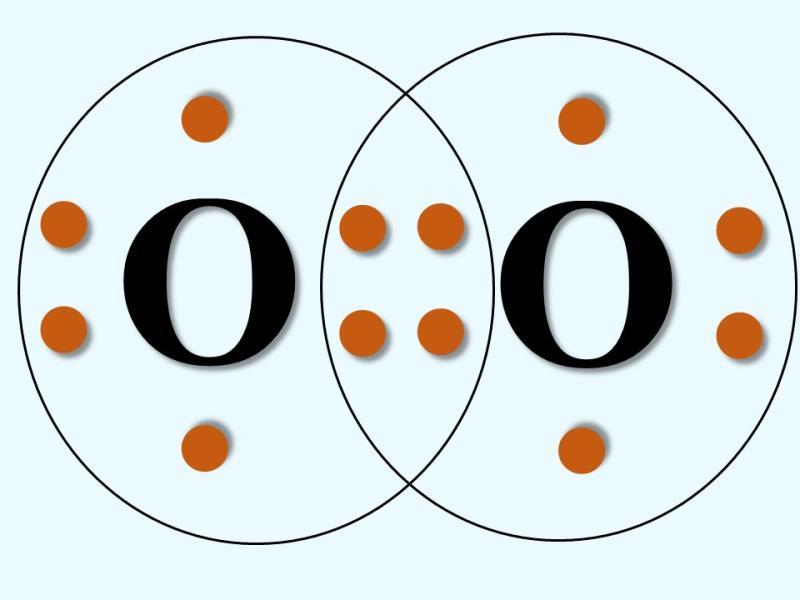
En este tipo de enlace dos pares compartidos de electrones forman enlaces; es decir, cuatro electrones son compartidos. Se representa con dos rayas; por ejemplo, en el caso del oxígeno gaseoso (O2):
Enlace covalente triple
Este enlace, el más fuerte que existe entre los enlaces covalentes, se da cuando los átomos comparten seis electrones o tres pares. Es representado con tres rayas y se puede observar en moléculas como el nitrógeno gaseoso (N2):

Enlace covalente normal
En este enlace, los átomos comparten sus electrones por igual; esto es, si dos forman un enlace simple (dos electrones) cada uno aportará un electrón.
Enlace covalente dativo o coordinado
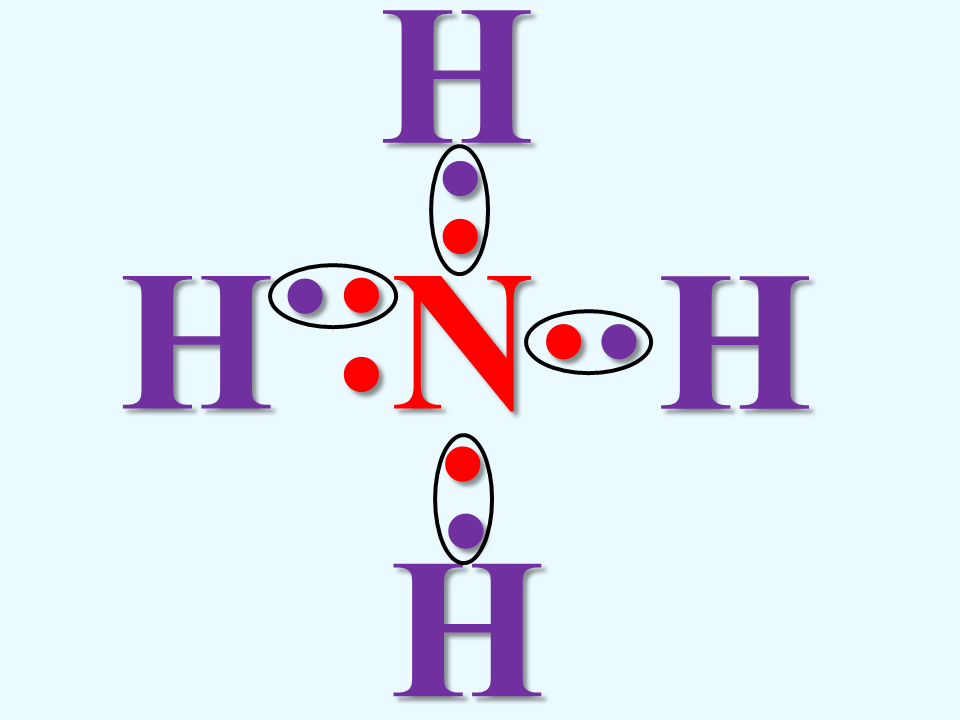
En este tipo de enlaces, un átomo comparte sus electrones a otro átomo sin recibir electrones a cambio. Esto se deeb al hecho de que si recibiese electrones, sobreapasaría la regla del octeto. Un ejemplo típico es el formado por el ion amonio (NH4):